Triosa fosfat isomerase
Triosa-fosfat isomerase (TPI atau TIM) ialah enzim (EC 5.3.1.1) yang memangkinkan pertukaran boleh balik bagi isomer triosa fosfat dihidroksiaseton fosfat dan D-gliseraldehid 3-fosfat.
| triosa fosfat isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
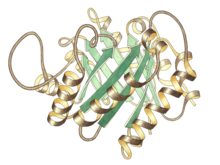 Pandangan sisi monomer triosa fosfat isomerase; tapak aktif di atas tengah | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 5.3.1.1 | ||||||||
| Nombor CAS | 9023-78-3 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
TPI memainkan peranan penting dalam glikolisis dan penting untuk pengeluaran tenaga yang cekap. TPI telah ditemui dalam hampir setiap organisma yang diselidik, termasuk haiwan seperti mamalia dan serangga serta dalam kulat, tumbuhan dan bakteria. Walau bagaimanapun, sesetengah bakteria yang tidak melakukan glikolisis seperti ureaplasma tidak memiliki TPI.
Pada manusia, kekurangan dalam TPI dikaitkan dengan gangguan neurologi yang progresif dan teruk dipanggil kekurangan triosa fosfat isomerase. Kekurangan triose fosfat isomerase dicirikan oleh anemia hemolisis kronik. Walaupun terdapat pelbagai mutasi yang menyebabkan penyakit ini, kebanyakannya memiliki penggantian asid glutamat pada kedudukan 104 dengan asid aspartik.[1]
Isomerase fosfat triose ialah enzim yang sangat cekap, melakukan tindak balas berbilion kali lebih cepat daripada yang berlaku secara semula jadi dalam larutan. Tindak balas adalah sangat cekap sehingga dikatakan sempurna dari segi pemangkinan: ia hanya dihadkan dengan kadar substrat yang boleh meresap masuk keluar dari tapak aktif enzim.[2][3]
Mekanisme
suntingMekanisme ini melibatkan pembentukan perantaraan enediol. Tenaga bebas relatif bagi setiap keadaan tanah dan keadaan peralihan telah ditentukan secara eksperimen, dan dipaparkan dalam rajah.[2]
Struktur TPI memudahkan penukaran antara dihidroksiaseton fosfat (DHAP) dan gliseraldehid 3-fosfat (GAP). Sisa nukleofilik glutamat 165 TPI menyahprotonasi substrat,[4] dan sisa histidina elektrofilik 95 menderma proton untuk membentuk perantaraan enediol.[5][6] Apabila dinyahproton, enediolat kemudian runtuh dan mengeluarkan proton daripada glutamat terproton 165, membentuk produk GAP. Pemangkinan tindak balas terbalik berjalan secara analog, membentuk enediol yang sama tetapi dengan keruntuhan enediolat daripada oksigen di C2.[7]
Kadar aktiviti TPI adalah terhad oleh resapan. Daripada segi termodinamik, pembentukan DHAP diutamakan 20:1 berbanding pengeluaran GAP.[8] Walau bagaimanapun, dalam glikolisis, penggunaan GAP dalam langkah metabolisme seterusnya mendorong tindak balas ke arah pengeluarannya. TPI dihalang oleh ion sulfat, fosfat dan arsenat yang mengikat tapak aktif.[9] Perencat lain termasuk 2-fosfoglikolat, sebuah analog keadaan peralihan, dan D-gliserol-1-fosfat, analog substrat.[10]
Struktur
sunting| Triosa fosfat isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||||
| Simbol | TIM | ||||||||
| Pfam | PF00121 | ||||||||
| Klan Pfam | CL0036 | ||||||||
| InterPro | IPR000652 | ||||||||
| PROSITE | PDOC00155 | ||||||||
| SCOP | 1tph | ||||||||
| SUPERFAMILY | 1tph | ||||||||
| |||||||||
Triosa fosfat isomerase ialah dimer subunit yang sama, setiap satunya terdiri daripada kira-kira 250 sisa asid amino. Struktur tiga dimensi subunit mengandungi lapan heliks α di bahagian luar, dan lapan helai β selari di bahagian dalam. Dalam ilustrasi, tulang belakang reben setiap subunit diwarnakan dengan biru ke merah dari terminal N ke C. Motif struktur ini dipanggil balang αβ atau TIM, dan setakat ini, merupakan lipatan protein yang paling biasa diperhatikan. Tapak aktif enzim ini berada di tengah-tengah balang. Sisa asid glutamat dan histidina terlibat dalam mekanisme pemangkin. Urutan di sekeliling sisa tapak aktif dipelihara dalam semua isomerase triosa fosfat yang diketahui.
Struktur triosa fosfat isomerase menyumbang kepada fungsinya. Selain sisa glutamat dan histidina yang diletakkan dengan tepat untuk membentuk enediol, rantai 10 atau 11 asid amino di TPI bertindak sebagai gelung untuk menstabilkan perantaraan. Gelung yang dibentuk oleh molekul 166 hingga 176 menutup dan membentuk ikatan hidrogen kepada kumpulan fosfat substrat. Tindakan ini menstabilkan perantaraan enediol dan keadaan peralihan yang lain dalam laluan tindak balas.[7]
Di samping menjadikan tindak balas boleh dilaksanakan secara kinetik, gelung TPI mengasingkan perantaraan enediol reaktif untuk mengelakkan penguraian kepada metilglioksal dan fosfat bukan organik. Ikatan hidrogen antara enzim dan kumpulan fosfat substrat menjadikan penguraian tidak bercenderungan daripada segi stereoelektronik.[7] Metilglioksal adalah beracun dan disingkirkan melalui sistem glioksalase kalau terbentuk.[11] Kehilangan ikatan fosfat bertenaga tinggi dan substrat untuk selebihnya glikolisis menjadikan pembentukan metilglioksal tidak cekap.
Kajian menunjukkan bahawa lisina berhampiran dengan tapak aktif (pada kedudukan 12) juga penting untuk fungsi enzim. Lisina yang terproton dalam pH fisiologi boleh membantu meneutralkan cas negatif kumpulan fosfat. Apabila sisa lisina ini digantikan dengan asid amino neutral, TPI kehilangan semua fungsi, tetapi varian dengan asid amino bercas positif yang berbeza mengekalkan sebahagian fungsi.[12]
Rujukan
sunting- ^ "Triosephosphate isomerase deficiency: facts and doubts". IUBMB Life. 58 (12): 703–15. December 2006. doi:10.1080/15216540601115960. PMID 17424909.
- ^ a b "Free-energy profile of the reaction catalyzed by triosephosphate isomerase". Biochemistry. 15 (25): 5627–31. December 1976. doi:10.1021/bi00670a031. PMID 999838.
- ^ "Proton diffusion in the active site of triosephosphate isomerase". Biochemistry. 29 (18): 4312–7. May 1990. doi:10.1021/bi00470a008. PMID 2161683.
- ^ "On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 293 (1063): 159–71. June 1981. doi:10.1098/rstb.1981.0069. PMID 6115415.
- ^ "Triosephosphate isomerase: removal of a putatively electrophilic histidine residue results in a subtle change in catalytic mechanism". Biochemistry. 27 (16): 5948–60. August 1988. doi:10.1021/bi00416a019. PMID 2847777.
- ^ "Electrophilic catalysis in triosephosphate isomerase: the role of histidine-95". Biochemistry. 30 (12): 3011–9. March 1991. doi:10.1021/bi00226a005. PMID 2007138.
- ^ a b c "Enzyme catalysis: not different, just better". Nature. 350 (6314): 121–4. March 1991. doi:10.1038/350121a0. PMID 2005961.
- ^ "Proton transfer in the mechanism of triosephosphate isomerase". Biochemistry. 37 (47): 16828–38. November 1998. doi:10.1021/bi982089f. PMID 9843453.
- ^ "Kinetic properties of triose-phosphate isomerase from Trypanosoma brucei brucei. A comparison with the rabbit muscle and yeast enzymes". European Journal of Biochemistry. 168 (1): 69–74. October 1987. doi:10.1111/j.1432-1033.1987.tb13388.x. PMID 3311744.
- ^ "Crystallographic analysis of the complex between triosephosphate isomerase and 2-phosphoglycolate at 2.5-A resolution: implications for catalysis". Biochemistry. 29 (28): 6619–25. July 1990. doi:10.1021/bi00480a010. PMID 2204418.
- ^ "Brief history of glyoxalase I and what we have learned about metal ion-dependent, enzyme-catalyzed isomerizations". Archives of Biochemistry and Biophysics. 387 (1): 1–10. March 2001. doi:10.1006/abbi.2000.2253. PMID 11368170.
- ^ "Triosephosphate isomerase requires a positively charged active site: the role of lysine-12". Biochemistry. 33 (10): 2809–14. March 1994. doi:10.1021/bi00176a009. PMID 8130193.
Pautan luar
sunting- PDBe-KB menyediakan gambaran keseluruhan semua maklumat struktur yang tersedia dalam PDB untuk isomerase Triosephosphate Manusia