Suksinil koenzim A sintetase
Suksinil koenzim A sintetase (SCS, juga dikenali sebagai suksinil-KoA sintetase, suksinat tiokinase atau suksinat-KoA ligase) ialah enzim yang memangkinkan tindak balas berbalik suksinil-KoA kepada suksinat.[3] Enzim memudahkan gandingan tindak balas ini kepada pembentukan molekul trifosfat nukleosida (sama ada GTP atau ATP) daripada molekul fosfat tak organik dan molekul nukleosida difosfat (sama ada GDP atau ADP). Ia memainkan peranan penting sebagai salah satu pemangkin yang terlibat dalam kitaran asid sitrik, laluan pusat dalam metabolisme sel, dan ia terletak dalam matriks mitokondrion sel.[4]
| Suksinat-KoA ligase (pembentuk GDP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Suksinil-KoA sintetase khusus GTP khinzir dengan GTP. PDB Templat:PDBe[1] | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 6.2.1.4 | ||||||||
| Nombor CAS | 9014-36-2 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
| Suksinat-KoA ligase (pembentuk ADP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
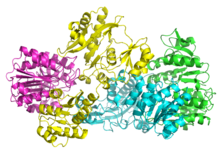 Suksinil-KoA sintetase Escherichia coli. PDB Templat:PDBe[2] | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 6.2.1.5 | ||||||||
| Nombor CAS | 9080-33-5 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
Tindak balas kimia dan mekanisme enzim
suntingSuksinil KoA sintetase memangkinkan tindak balas berbalik berikut:
- Suksini-KoA + Pi + NDP ↔ suksinat + KoA + NTP,
di mana Pi menandakan fosfat tak organik, NDP menandakan nukleotida difosfat (sama ada GDP atau ADP), dan NTP menandakan nukleotida trifosfat (sama ada GTP atau ATP). Seperti yang dinyatakan, enzim memudahkan gandingan penukaran suksinil-KoA kepada suksinat dengan pembentukan NTP daripada NDP dan Pi. Tindak balas mempunyai perubahan tenaga bebas keadaan piawai biokimia sebanyak -3.4 kJ/mol.[4] Tindak balas berlaku dengan mekanisme tiga langkah[3] yang digambarkan dalam imej di bawah. Langkah pertama melibatkan anjakan KoA daripada suksinil-KoA oleh molekul fosfat tak organik nukleofilik untuk membentuk suksinil fosfat. Enzim itu kemudiannya menggunakan sisa histidina untuk mengeluarkan kumpulan fosfat daripada suksinil fosfat dan menghasilkan suksinat. Akhirnya, histidina terfosforil memindahkan kumpulan fosfat kepada difosfat nukleosida, yang menjana trifosfat nukleosida pembawa tenaga tinggi.
Struktur
suntingSubunit
suntingSCS bakteria dan mamalia terdiri daripada subunit α dan β.[5] Dalam E. coli, dua heterodimer αβ bercantum untuk membentuk struktur heterotetramer α2β2. Walau bagaimanapun, SCS mitokondria mamalia aktif sebagai dimer αβ, dan tidak membentuk heterotetramer.[6] E. coli SCS heterotetramer telah dihablurkan dan dicirikan dengan sangat terperinci.[6][7] Seperti yang dapat dilihat dalam imej 2, dua subunit α (merah jambu dan hijau) berada di sisi bertentangan struktur, dan dua subunit β (kuning dan biru) berinteraksi di kawasan tengah protein. Kedua-dua subunit α hanya berinteraksi dengan unit β tunggal, manakala unit β berinteraksi dengan satu unit α tunggal (untuk membentuk dimer αβ) dan subunit β dimer αβ yang lain.[6] Rantai asid amino pendek menghubungkan dua subunit β yang menimbulkan struktur tetramerik.
Struktur kristal subunit alfa synthetase Succinyl-CoA (isoform pengikat succinyl-CoA) ditentukan oleh Joyce et al. kepada resolusi 2.10 A, dengan kod PDB 1CQJ. [1].[8]
Sisa pemangkinan
suntingStruktur hablur E. coli SCS memberikan bukti bahawa koenzim A mengikat dalam setiap subunit α (dalam lipatan Rossmann) berdekatan sisa histidina (His246α).[7] Sisa histidina ini terfosforil semasa langkah pembentukan suksinat dalam mekanisme tindak balas. Lokasi pengikatan suksinat yang tepat tidak ditakrifkan dengan baik.[9] Pembentukan nukleotida trifosfat berlaku dalam domain genggaman ATP yang terletak berhampiran terminal N setiap subunit β. Walau bagaimanapun, domain genggaman ini terletak kira-kira 35 Å dari sisa histidina terfosforil.[8] Ini menyebabkan penyelidik percaya bahawa enzim mesti mengalami perubahan konformasi yang besara untuk membawa histidina ke domain genggaman dan memudahkan pembentukan nukleosida trifosfat. Eksperimen mutagenesis telah menentukan bahawa dua sisa glutamat (satu berhampiran histidina pemangkin, Glu208α dan satu berhampiran domain cengkaman ATP, Glu197β) memainkan peranan dalam pemfosforilan dan penyahfosforilan histidina, tetapi mekanisme tepat berkenaan cara enzim mengubah konformasi belum difahami sepenuhnya.[9]
Isobentuk
suntingJohnson et al. huraikan dua isobentuk suksinil-KoA sintetase dalam amniot, yakni satu yang menentukan sintesis ATP, dan satu yang mensintesis GTP.[10]
Dalam amniot, enzim ialah heterodimer bagi subunit α dan β. Kekhususan untuk adenosina atau guanosina fosfat ditakrifkan oleh subunit β[10] yang dikodkan oleh 2 gen. SUCLG2 adalah khusus GTP dan SUCLA2 adalah khusus ATP, manakala SUCLG1 mengekod subunit α biasa. Varian β dihasilkan pada jumlah yang berbeza dalam tisu yang berbeza,[10] menyebabkan keperluan substrat GTP atau ATP.
Kebanyakan tisu pemakan seperti jantung dan otak mempunyai lebih banyak enzim jenis ATP (ATPSCS), manakala tisu pensintesis seperti buah pinggang dan hati cenderung mempunyai bentuk khusus GTP (GTPSCS).[11] Analisis kinetik ATPSCS dari otot payudara merpati dan GTPSCS dari hati merpati menunjukkan bahawa pemalar Michaelis yang jelas adalah serupa bagi KoA, tetapi berbeza terhadap nukleotida, fosfat, dan suksinat. Perbezaan terbesar adalah untuk suksinat: Km aplikasi ATPSCS = 5mM berbanding GTPSCS = 0.5mM.[10]
Fungsi
suntingPenjanaan nukleotida trifosfat
suntingSCS ialah satu-satunya enzim dalam kitaran asid sitrik yang memangkinkan tindak balas di mana nukleotida trifosfat (GTP atau ATP) dibentuk oleh pemfosforilan peringkat substrat.[4] Kajian penyelidikan telah menunjukkan bahawa E. coli SCS boleh memangkin sama ada pembentukan GTP atau ATP.[7] Walau bagaimanapun, mamalia mempunyai pelbagai jenis SCS yang khusus terhadap GTP (G-SCS) atau ATP (A-SCS), dan berasal dari pelbagai jenis tisu dalam organisma. Kajian menarik menggunakan sel merpati menunjukkan bahawa SCS khusus GTP terletak dalam sel hati merpati, dan SCS khusus ATP terletak di dalam sel otot payudara merpati.[12] Penyelidikan lanjut mendedahkan fenomena serupa GTP dan SCS khusus ATP dalam tisu tikus dan manusia. Nampaknya tisu yang biasanya terlibat dalam metabolisme anabolik (seperti hati dan buah pinggang) mengekspresikan G-SCS, manakala tisu yang terlibat dalam metabolisme katabolik (seperti otak, jantung dan tisu otot) mengekspresikan A-SCS.[11]
Pembentukan perantara metabolik
suntingSCS memudahkan fluks molekul ke dalam laluan metabolik lain dengan mengawal pertukaran antara suksinil-KoA dan suksinat.[13] Ini penting kerana suksinil-KoA ialah perantaraan yang diperlukan dalam biosintesis porfirin, hem[14] dan badan keton.[15]
Peraturan dan perencatan
suntingDalam sesetengah bakteria, enzim dikawal di tahap transkripsi.[16] Ada ketampakan bahawa gen SCS (sucCD) ditranskripsikan bersama-sama gen untuk α-ketoglutarat dehidrogenase (sucAB) di bawah kawalan promoter yang dipanggil sdhC, sebahagian daripada operon suksinat dehidrogenase. Operon ini dikawal selia dengan kehadiran oksigen, dan bertindak balas terhadap pelbagai sumber karbon. Ubat antibakteria yang menghalang pemfosforilan histidina seperti molekul LY26650 ialah perencat kuat SCS bakteria.[17]
Aktiviti optimum
suntingPengukuran (dengan SCS kacang soya) menunjukkan suhu optimum 37 °C dan pH optimum 7.0-8.0.[18]
Peranan dalam penyakit
suntingSCS yang rosak telah dikaitkan sebagai punca asidosis laktik bayi maut, iaitu penyakit bayi yang dicirikan oleh pengumpulan tahap asid laktik beracun. Keadaan (apabila ia paling teruk) mengakibatkan kematian biasanya dalam masa 2-4 hari selepas kelahiran.[19] Telah ditentukan bahawa pesakit dengan keadaan ini memaparkan pemadaman dua pasangan bes dalam gen yang dikenali sebagai SUCLG1 yang mengekodkan subunit α SCS.[19] Akibatnya, SCS berfungsi tidak hadir dalam metabolisme, menyebabkan ketidakseimbangan besar dalam fluks antara glikolisis dan kitaran asid sitrik. Oleh kerana sel tidak mempunyai kitaran asid sitrik yang berfungsi, asidosis berlaku kerana sel terpaksa memilih pengeluaran asid laktik sebagai cara utama untuk menghasilkan ATP.
Rujukan
sunting- ^ Fraser ME, Hayakawa K, Hume MS, Ryan DG, Brownie ER (Apr 2006). "Interactions of GTP with the ATP-grasp domain of GTP-specific succinyl-CoA synthetase". The Journal of Biological Chemistry. 281 (16): 11058–65. doi:10.1074/jbc.M511785200. PMID 16481318.
- ^ Fraser ME, James MN, Bridger WA, Wolodko WT (Jan 1999). "A detailed structural description of Escherichia coli succinyl-CoA synthetase". Journal of Molecular Biology. 285 (4): 1633–53. doi:10.1006/jmbi.1998.2324. PMID 9917402.
- ^ a b Voet, Donald J. (2011). Biochemistry / Donald J. Voet ; Judith G. Voet. New York, NY: Wiley, J. ISBN 978-0-470-57095-1.
- ^ a b c Berg, Jeremy M. (Jeremy M.); Tymoczko, John L.; Stryer, Lubert.; Stryer, Lubert. Biochemistry. (2002). Biochemistr. New York: W.H. Freeman. m/s. 475–477. ISBN 0-7167-3051-0.
- ^ Nishimura JS (1986). "Succinyl-CoA synthetase structure-function relationships and other considerations". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology and Related Areas of Molecular Biology. 58. m/s. 141–72. doi:10.1002/9780470123041.ch4. ISBN 9780470123041. PMID 3521216.
- ^ a b c "Active enzyme sedimentation, sedimentation velocity, and sedimentation equilibrium studies of succinyl-CoA synthetases of porcine heart and Escherichia coli". Biochemistry. 25 (19): 5420–5. Sep 1986. doi:10.1021/bi00367a012. PMID 3535876.
- ^ a b c "A detailed structural description of escherichia coli succinly-CoA synthetase". Journal of Molecular Biology. 288 (3): 501. May 1999. doi:10.1006/jmbi.1999.2773. PMID 10329157.
- ^ a b "ADP-binding site of Escherichia coli succinyl-CoA synthetase revealed by x-ray crystallography". Biochemistry. 39 (1): 17–25. Jan 2000. doi:10.1021/bi991696f. PMID 10625475.
- ^ a b "Two glutamate residues, Glu 208 alpha and Glu 197 beta, are crucial for phosphorylation and dephosphorylation of the active-site histidine residue in succinyl-CoA synthetase". Biochemistry. 41 (2): 537–46. Jan 2002. doi:10.1021/bi011518y. PMID 11781092.
- ^ a b c d "Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes". The Journal of Biological Chemistry. 273 (42): 27580–6. Oct 1998. doi:10.1074/jbc.273.42.27580. PMID 9765291.
- ^ a b "Expression of two succinyl-CoA synthetases with different nucleotide specificities in mammalian tissues". The Journal of Biological Chemistry. 279 (35): 36621–4. Aug 2004. doi:10.1074/jbc.M406884200. PMID 15234968.
- ^ "Characterization of the ATP- and GTP-specific succinyl-CoA synthetases in pigeon. The enzymes incorporate the same alpha-subunit". The Journal of Biological Chemistry. 273 (42): 27573–9. Oct 1998. doi:10.1074/jbc.273.42.27573. PMID 9765290.
- ^ "The role of succinyl-CoA synthetase in the control of heme biosynthesis". Biochimica et Biophysica Acta (BBA) - General Subjects. 111 (2): 403–15. Dec 1965. doi:10.1016/0304-4165(65)90050-4. PMID 5879477.
- ^ "Succinic thiokinase and metabolic control". The International Journal of Biochemistry. 13 (4): 401–10. 1981. doi:10.1016/0020-711x(81)90111-7. PMID 6263728.
- ^ "Distinct physiological roles of animal succinate thiokinases. Association of guanine nucleotide-linked succinate thiokinase with ketone body utilization". FEBS Letters. 205 (2): 215–8. Sep 1986. doi:10.1016/0014-5793(86)80900-0. PMID 2943604.
- ^ "[Knotty reticulosis with keloid formation]". Zeitschrift für Hautkrankheiten. 50 (3): 117–25. Feb 1975. PMID 179232.
- ^ "Inhibition of succinyl CoA synthetase histidine-phosphorylation in Trypanosoma brucei by an inhibitor of bacterial two-component systems". Molecular and Biochemical Parasitology. 100 (1): 53–9. May 1999. doi:10.1016/s0166-6851(99)00032-8. PMID 10376993.
- ^ Wider de Xifra, EA.; del C Batlle, AM (Mar 1978). "Porphyrin biosynthesis: immobilized enzymes and ligands. VI. Studies on succinyl CoA synthetase from cultured soya bean cells". Biochimica et Biophysica Acta. 523 (1): 245–9. doi:10.1016/0005-2744(78)90027-x. PMID 564714.
- ^ a b "Deficiency of the alpha subunit of succinate-coenzyme A ligase causes fatal infantile lactic acidosis with mitochondrial DNA depletion". American Journal of Human Genetics. 81 (2): 383–7. Aug 2007. doi:10.1086/519222. PMC 1950792. PMID 17668387.
Pautan luar
sunting- Succinyl+Coenzyme+A+Synthetases dalam Tajuk Subjek Perubatan (MeSH) di Perpustakaan Perubatan Negara AS