Protein membran integral
Protein membran integral (IMP) atau intrinsik[1] ialah sejenis protein membran yang melekat secara kekal di membran biologi. Semua protein transmembran boleh dikelaskan sebagai IMP, tetapi tidak semua IMP ialah protein transmembran.[2] IMP terdiri daripada sebahagian besar daripada protein yang dikodkan dalam genom organisma.[3] Protein yang melintasi membran dikelilingi oleh lipid anulus, yang ditakrifkan sebagai lipid yang bersentuhan langsung dengan protein membran. Protein sedemikian hanya boleh diasingkan daripada membran dengan menggunakan detergen, pelarut tak berkutub, atau kadangkala agen penyahaslian.
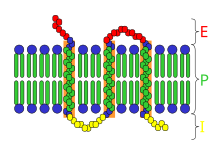
Protein yang melekat hanya sementara pada membran sel dikenali sebagai protein membran periferi. Protein ini sama ada boleh dikaitkan dengan protein membran integral, atau secara bebas memasukkan dalam dwilapisan lipid dalam beberapa cara.
Struktur
suntingStruktur tiga dimensi ~160 protein membran integral yang berbeza telah ditentukan dalam resolusi atom oleh kristalografi sinar-X atau spektroskopi resonans magnetik nuklear. Ia merupakan satu subjek yang mencabar untuk dipelajari kerana kesukaran yang berkaitan dengan pengekstrakan dan penghabluran. Selain itu, struktur banyak domain protein larut air bagi IMP tersedia dalam Protein Data Bank. Heliks α yang berlabuh membran mereka telah dikeluarkan untuk memudahkan pengekstrakan dan penghabluran. Cari protein membran integral dalam PDB (berdasarkan klasifikasi ontologi gen)
IMP boleh dibahagikan kepada dua kumpulan:
- Protein politopik integral (protein transmembran)
- Protein monotopik integral
Protein politopik integral
suntingJenis IMP yang paling biasa ialah protein transmembran yang merentasi keseluruhan membran biologi. Protein membran lalu tunggal melintasi membran hanya sekali, manakala protein membran lalu berbilang menenun masuk keluar, dan melintasi membran beberapa kali. Protein membran lalu tunggal boleh dikategorikan sebagai Jenis I, ketika mana protein diposisikan sedemikian rupa sehingga terminal karboksilnya menghala ke sitosol, atau Jenis II yang mempunyai terminal amino ke arah sitosol. Protein jenis III mempunyai beberapa domain transmembran dalam satu polipeptida, manakala jenis IV terdiri daripada beberapa polipeptida berbeza yang dipasang bersama dalam saluran melalui membran. Protein jenis V berlabuh di dwilapisan lipid melalui lipid yang diikat secara kovalen. Akhirnya, protein Jenis VI mempunyai kedua-dua domain transmembran dan penambat lipid.[4]
Protein monotopik bersepadu
suntingProtein monotopik integral dikaitkan dengan membran dari satu sisi tetapi tidak merentangi dwilapisan lipid sepenuhnya.
Pengekstrakan
suntingBanyak cabaran yang dihadapi dalam kajian protein membran integral dikaitkan dengan pengekstrakan protein tersebut daripada dwilapisan fosfolipid. Oleh kerana protein integral menjangkau keseluruhan dwilapisan fosfolipid, pengekstrakan mereka melibatkan penggangguan fosfolipid di sekelilingnya tanpa mengganggu protein sehingga merosakkan fungsi atau strukturnya. Beberapa kaedah yang berjaya tersedia untuk melaksanakan pengekstrakan termasuk penggunaan "detergen, garam ionik rendah (penggaraman keluar), daya ricih, dan perubahan tekanan yang cepat."[5]
Penentuan struktur protein
suntingInisiatif Struktur Protein (PSI) yang dibiayai oleh Institut Sains Perubatan Am Kebangsaan (NIGMS), sebahagian daripada Institut Kesihatan Kebangsaan (NIH), mempunyai matlamat untuk menentukan struktur protein tiga dimensi dan untuk membangunkan teknik untuk digunakan dalam biologi struktur, termasuk untuk protein membran. Pemodelan homologi boleh digunakan untuk membina model resolusi atom protein integral "sasaran" daripada jujukan asid aminonya dan struktur tiga dimensi percubaan bagi protein homolog berkaitan. Prosedur ini telah digunakan secara meluas bagi gabungan ligan-reseptor bergandingan protein G (GPCR) dan kompleksnya.[6]
Fungsi
suntingIMP termasuk pengangkut, penghubung, saluran, reseptor, enzim, domain penambat membran struktur, protein yang terlibat dalam pengumpulan dan transduksi tenaga, dan protein yang bertanggungjawab dalam lekatan sel. Pengelasan pengangkut boleh didapati dalam Pangkalan Data Pengelasan Pengangkut.[7]
Sebagai contoh hubungan antara IMP (dalam kes ini pigmen fotoperangkap bakteria, bacteriorhodopsin) dan membran yang dibentuk oleh dwilapisan fosfolipid digambarkan di bawah. Dalam kes ini, protein membran integral merentangi dwilapisan fosfolipid tujuh kali. Bahagian protein yang tertanam dalam kawasan hidrofobik dwilapisan adalah alfa heliks dan terdiri daripada kebanyakan asid amino hidrofobik. Hujung terminal C protein berada di dalam sitosol manakala kawasan terminal N berada di luar sel. Membran yang mengandungi protein tertentu ini dapat berfungsi dalam fotosintesis.[8]
Rujukan
sunting- ^ "intrinsic protein | biology". Britannica (dalam bahasa Inggeris). Dicapai pada 2022-07-04.
- ^ Steven R. Goodman (2008). Medical cell biology. Academic Press. m/s. 37–. ISBN 978-0-12-370458-0. Dicapai pada 24 November 2010.
- ^ "Genome-wide analysis of integral membrane proteins from eubacterial, archaean, and eukaryotic organisms". Protein Science. 7 (4): 1029–38. 1998. doi:10.1002/pro.5560070420. PMC 2143985. PMID 9568909.
- ^ Nelson, D. L., & Cox, M. M. (2008). Principles of Biochemistry (5th ed., p. 377). New York, NY: W.H. Freeman and Company.
- ^ Muinao, Thingreila; Pal, Mintu; Boruah, Hari Prasanna Deka (2018). "Cytosolic and Transmembrane Protein Extraction Methods of Breast and Ovarian Cancer Cells: A Comparative Study". Journal of Biomolecular Techniques. 29 (3): 71–78. doi:10.7171/jbt.18-2903-002. ISSN 1524-0215. PMC 6091320. PMID 30174558.
- ^ "Structural model of ligand-G protein-coupled receptor (GPCR) complex based on experimental double mutant cycle data: MT7 snake toxin bound to dimeric hM1 muscarinic receptor". J Biol Chem. 286 (36): 31661–75. September 2011. doi:10.1074/jbc.M111.261404. PMC 3173127. PMID 21685390.
- ^ "The Transporter Classification Database: recent advances". Nucleic Acids Res. 37 (Database issue): D274–8. January 2009. doi:10.1093/nar/gkn862. PMC 2686586. PMID 19022853.
- ^ "Integral membrane proteins". academic.brooklyn.cuny.edu. Diarkibkan daripada yang asal pada 1 February 2015. Dicapai pada 29 January 2015.