Glikogen fosforilase
Glikogen fosforilase ialah sejenis enzim fosforilase (EC 2.4.1.1). Fosforilase glikogen memangkinkan langkah pengehad kadar dalam glikogenolisis pada haiwan, dengan membebaskan glukosa-1-fosfat daripada ikatan alfa-1,4-glikosidik terminal. Fosforilase ini juga dikaji sebagai protein model yang dikawal oleh kedua-dua pemfosforilan berbalik dan kesan alosterik.
| Glikogen fosforilase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
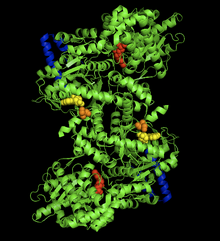 Struktur hablur kompleks glikogen fosforilase-AMP otot arnab. Tapak alosterik AMP (kuning), Ser14 terfosforilasi (oren), tapak pengikat glikogen (biru), tapak pemangkin (merah).[1] | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 2.4.1.1 | ||||||||
| Nombor CAS | 9035-74-9 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
Mekanisme
suntingFosforilase glikogen memecah glikogen kepada subunit glukosa (lihat juga rajah di bawah):
(rantai glikogen α-1,4)n + Pi ⇌ (rantai glikogen α-1,4)n-1 + α-D-glukosa-1-fosfat.[2]
Glikogen ditinggalkan dengan satu molekul glukosa yang lebih sedikit, dan molekul glukosa bebas adalah dalam bentuk glukosa-1-fosfat. Untuk digunakan dalam metabolisme, ia mesti ditukar kepada glukosa-6-fosfat oleh enzim fosfoglukomutase.
Walaupun tindak balas boleh diterbalikkan secara in vitro, di dalam sel enzim hanya berfungsi ke arah hadapan seperti yang ditunjukkan di bawah kerana kepekatan fosfat tak organik jauh lebih tinggi daripada glukosa-1-fosfat.[2]
Glikogen fosforilase boleh bertindak hanya pada rantaian linear glikogen (ikatan α-1-4 glikosidik). Kerjanya akan terhenti serta-merta di kedudukan sisa keempat dari cabang α-1-6 glikogen. Dalam situasi ini, enzim penyahcabangan diperlukan, yang akan meluruskan rantai di kawasan itu. Di samping itu, enzim transferase mengalihkan blok 3 sisa glukosil dari cabang luaran ke hujung lain, dan kemudian, enzim α-1-6 glukosidase diperlukan untuk memecahkan baki (glukosa tunggal) α-1-6 kekal ke dalam rantai linear. Selepas semua ini dilakukan, glikogen fosforilase boleh diteruskan. Enzim ini khusus bagi rantai α-1-4 kerana molekulnya mengandungi celah sepanjang 30 angstrom dengan jejari yang sama dengan heliks yang dibentuk oleh rantai glikogen; ini menampung 4-5 sisa glukosil, tetapi terlalu sempit bagi kawasan cabang. Celah ini menghubungkan tapak penyimpanan glikogen ke tapak pemangkin yang aktif.
Struktur
suntingMonomer glikogen fosforilase ialah protein besar, terdiri daripada 842 asid amino dengan jisim 97.434 kDa dalam sel otot. Walaupun enzim boleh wujud sebagai monomer atau tetramer tidak aktif, ia aktif secara biologi sebagai dimer dua subunit yang sama.[3]
Kepentingan klinikal
sunting| fosforilase, glikogen; otot (sindrom McArdle, penyakit penyimpanan glikogen jenis V) | |||||||
|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||
| Simbol | PYGM | ||||||
| Gen NCBI | 5837 | ||||||
| HGNC | 9726 | ||||||
| OMIM | 608455 | ||||||
| RefSeq | NM_005609 | ||||||
| UniProt | P11217 | ||||||
| Other data | |||||||
| Nombor EC | 2.4.1.1 | ||||||
| Lokus | Kromosom 11 q12-q13.2 | ||||||
| |||||||
| fosforilase, glikogen; otot (penyakit Hers, penyakit penyimpanan glikogen jenis VI) | |||||||
|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||
| Simbol | PYGL | ||||||
| Gen NCBI | 5836 | ||||||
| HGNC | 9725 | ||||||
| OMIM | 232700 | ||||||
| RefSeq | NM_002863 | ||||||
| UniProt | P06737 | ||||||
| Other data | |||||||
| Nombor EC | 2.4.1.1 | ||||||
| Lokus | Kromosom 14 q11.2-24.3 | ||||||
| |||||||
| fosforilase, glikogen; otak | |||||||
|---|---|---|---|---|---|---|---|
| Pengenal pasti | |||||||
| Simbol | PYGB | ||||||
| Gen NCBI | 5834 | ||||||
| HGNC | 9723 | ||||||
| OMIM | 138550 | ||||||
| RefSeq | NM_002862 | ||||||
| UniProt | P11216 | ||||||
| Other data | |||||||
| Nombor EC | 2.4.1.1 | ||||||
| Lokus | Kromosom 20 p11.2-p11.1 | ||||||
| |||||||
Perencatan glikogen fosforilase pernah diusul sebagai satu kaedah rawatan diabetes jenis 2.[4] Oleh kerana penghasilan glukosa hati diperhatikan meningkat dalam kalangan pesakit diabetes ini,[5] perencatan pelepasan glukosa daripada bekalan glikogen nampak seperti satu pendekatan yang munasabah. Pengklonan glikogen fosforilase hati manusia (HLGP) mendedahkan tapak pengikat alosterik baharu berhampiran antara muka subunit yang tidak terdapat dalam glikogen fosforilase otot arnab (RMGP) yang biasanya digunakan dalam kajian. Tapak ini tidak sensitif terhadap perencat yang sama seperti yang terdapat di tapak alosterik AMP,[6] dan kebanyakan kejayaan ialah penghasilan perencat baharu yang meniru struktur glukosa kerana glukosa 6-fosfat diketahui sebagai perencat HLGP, dan menstabilkan keadaan T yang kurang aktif.[7] Terbitan glukosa ini memiliki suatu kejayaan dalam merencatkan HLGP, dengan nilai Ki anggaran adalah serendah 0.016 mM.[8]
Mutasi isobentuk otot glikogen fosforilase (PYGM) dikaitkan dengan penyakit penyimpanan glikogen jenis V (GSD V atau penyakit McArdle). Lebih 65 mutasi dalam gen PYGM yang membawa kepada penyakit McArdle telah dikenal pasti setakat ini.[9][10] Gejala penyakit McArdle termasuk lemah otot, mialgia dan kekurangan daya tahan tenaga, dengan kesemuanya berpunca daripada tahap glukosa otot yang rendah.[11]
Mutasi di isobentuk hati pula dikaitkan dengan penyakit Hers (penyakit penyimpanan glikogen jenis VI).[12][13] Penyakit Hers biasanya dikaitkan dengan gejala ringan yang dikaitkan dengan hipoglisemia, dan kadangkala sukar didiagnosis oleh kerana aktiviti enzim sampingan.[14]
Isobentuk otak pula telah dicadangkan sebagai biopenanda barah gastrik.[15]
Pengawalaturan
suntingFosforilase glikogen dikawal melalui kawalan alosterik dan melalui fosforilasi . Fosforilase a dan fosforilase b masing-masing wujud dalam dua bentuk keadaan T (tegang) yang tidak aktif dan R (relaks). Fosforilase b biasanya dalam keadaan T, tidak aktif kerana kehadiran fisiologi ATP dan glukosa 6-fosfat, dan fosforilase a biasanya dalam keadaan R (aktif). Isoenzim glikogen fosforilase wujud dalam hati yang sensitif terhadap kepekatan glukosa, kerana hati bertindak sebagai pengeksport glukosa. Pada dasarnya, fosforilase hati adalah responsif kepada glukosa, yang menyebabkan peralihan yang sangat responsif dari bentuk R ke T, menyahaktifkannya; tambahan pula, fosforilase hati tidak sensitif kepada AMP.
Hormon seperti epinefrina, insulin dan glukagon mengawal selia glikogen fosforilase menggunakan sistem penguatan pengutus kedua yang dikaitkan dengan protein G. Glukagon mengaktifkan adenilat siklase melalui reseptor bergandingan protein G yang digabungkan dengan Gs, dan seterusnya mengaktifkan adenilat siklase untuk meningkatkan kepekatan intrasel cAMP. cAMP mengikat dan mengaktifkan protein kinase A (PKA). PKA memfosforilasi fosforilase kinase, yang seterusnya memfosforilasi glikogen fosforilase b pada Ser14, menukarkannya kepada glikogen fosforilase a aktif.
Lihat juga
suntingRujukan
sunting- ^ PDB: 3E3N
- ^ a b "Pyridoxal 5'-phosphate as a catalytic and conformational cofactor of muscle glycogen phosphorylase B". Biochemistry. Biokhimiia. 67 (10): 1089–98. October 2002. doi:10.1023/A:1020978825802. PMID 12460107.
- ^ "Phosphorylase: a biological transducer". Trends in Biochemical Sciences. 17 (2): 66–71. February 1992. doi:10.1016/0968-0004(92)90504-3. PMID 1566331.
- ^ Somsák L, Nagya V, Hadady Z, Docsa T, Gergely P (2003). "Glucose analog inhibitors of glycogen phosphorylases as potential antidiabetic agents: recent developments". Current Pharmaceutical Design. 9 (15): 1177–89. doi:10.2174/1381612033454919. PMID 12769745.
- ^ Moller DE (December 2001). "New drug targets for type 2 diabetes and the metabolic syndrome". Nature. 414 (6865): 821–7. Bibcode:2001Natur.414..821M. doi:10.1038/414821a. PMID 11742415. S2CID 4426975.
- ^ Coats WS, Browner MF, Fletterick RJ, Newgard CB (August 1991). "An engineered liver glycogen phosphorylase with AMP allosteric activation". The Journal of Biological Chemistry. 266 (24): 16113–9. doi:10.1016/S0021-9258(18)98523-6. PMID 1874749.
- ^ Oikonomakos NG, Kontou M, Zographos SE, Tsitoura HS, Johnson LN, Watson KA, dll. (Jul 1994). "The design of potential antidiabetic drugs: experimental investigation of a number of beta-D-glucose analogue inhibitors of glycogen phosphorylase". European Journal of Drug Metabolism and Pharmacokinetics. 19 (3): 185–92. doi:10.1007/BF03188920. PMID 7867660. S2CID 11168623.
- ^ Hopfinger AJ, Reaka A, Venkatarangan P, Duca JS, Wang S (Sep 1999). "Prediction of Ligand−Receptor Binding Free Energy by 4D-QSAR Analysis: Application to a Set of Glucose Analogue Inhibitors of Glycogen Phosphorylase". Journal of Chemical Information and Computer Sciences. 39 (6): 1141–1150. doi:10.1021/ci9900332.
- ^ Nogales-Gadea G, Arenas J, Andreu AL (January 2007). "Molecular genetics of McArdle's disease". Current Neurology and Neuroscience Reports. 7 (1): 84–92. doi:10.1007/s11910-007-0026-2. PMID 17217859. S2CID 39626196.
- ^ Andreu AL, Nogales-Gadea G, Cassandrini D, Arenas J, Bruno C (July 2007). "McArdle disease: molecular genetic update". Acta Myologica. 26 (1): 53–7. PMC 2949323. PMID 17915571.
- ^ Grünfeld JP, Ganeval D, Chanard J, Fardeau M, Dreyfus JC (June 1972). "Acute renal failure in McArdle's disease. Report of two cases". The New England Journal of Medicine. 286 (23): 1237–41. doi:10.1056/NEJM197206082862304. PMID 4502558.
- ^ Burwinkel B, Bakker HD, Herschkovitz E, Moses SW, Shin YS, Kilimann MW (April 1998). "Mutations in the liver glycogen phosphorylase gene (PYGL) underlying glycogenosis type VI". American Journal of Human Genetics. 62 (4): 785–91. doi:10.1086/301790. PMC 1377030. PMID 9529348.
- ^ Chang S, Rosenberg MJ, Morton H, Francomano CA, Biesecker LG (May 1998). "Identification of a mutation in liver glycogen phosphorylase in glycogen storage disease type VI". Human Molecular Genetics. 7 (5): 865–70. doi:10.1093/hmg/7.5.865. PMID 9536091.
- ^ Tang NL, Hui J, Young E, Worthington V, To KF, Cheung KL, dll. (June 2003). "A novel mutation (G233D) in the glycogen phosphorylase gene in a patient with hepatic glycogen storage disease and residual enzyme activity". Molecular Genetics and Metabolism. 79 (2): 142–5. doi:10.1016/S1096-7192(03)00068-4. PMID 12809646.
- ^ Shimada S, Matsuzaki H, Marutsuka T, Shiomori K, Ogawa M (July 2001). "Gastric and intestinal phenotypes of gastric carcinoma with reference to expression of brain (fetal)-type glycogen phosphorylase". Journal of Gastroenterology. 36 (7): 457–64. doi:10.1007/s005350170068. PMID 11480789. S2CID 25602637.