Atrofi otot spina
Atrofi otot spina/saraf tunjang (SMA; spinal muscular atrophy) adalah gangguan neuron-otot yang jarang berlaku yang mengakibatkan kehilangan neuron motor dan atrofi (penguraian) otot yang progresif.[3][4][5] Ia biasanya didiagnosis pada masa bayi atau awal kanak-kanak dan jika tidak dirawat ia adalah punca genetik yang paling biasa bagi kematian bayi.[6] Ia juga mungkin muncul pada tempoh terkemudian, dan kemudian mempunyai perjalanan penyakit yang lebih ringan. Ciri biasa ialah kelemahan progresif otot sukarela, dengan otot lengan, kaki dan pernafasan terjejas terlebih dahulu.[7][8] Masalah yang berkaitan mungkin termasuk kawalan kepala yang lemah, kesukaran menelan, skoliosis dan kontraktur sendi.[2][8]
| Atrofi otot spina | |
|---|---|
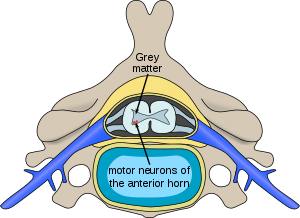 | |
| Kedudukan neuron terjejas dengan atrofi otot spina di saraf tunjang | |
| Pengkhususan | Neurologi |
| Gejala | Pelemahan otot progresif[1] |
| Kerumitan | Skoliosis, kontraktur sendi, pneumonia[2] |
Permulaan biasa | Mutasi sejak lahir, gejala bermula berbeza mengikut jenis |
| Tempoh | Sepanjang hayat |
| Jenis | Jenis 0 ke jenis 4[2] |
| Punca | Mutasi SMN1[2] |
| Ujian genetik[1] | |
| Distrofi otot kongenital, distrofi otot Duchenne, sindrom Prader-Willi[2] | |
| Rawatan | Penjagaan sokongan, perubatan[1] |
Rawatan perubatan | Nusinersen, onasemnogen abeparvovek, Risdiplam |
| Prognosis | Bergantung ikut jenis[2] |
| Kekerapan | 1 dalam 10,000 orang[2] |
| sunting | |
Umur permulaan dan keterukan gejala membentuk asas klasifikasi tradisional atrofi otot tulang belakang kepada beberapa jenis.[4]
Atrofi otot tulang belakang adalah disebabkan oleh kelainan (mutasi) dalam gen SMN1[1][2] yang mengekod SMN, suatu protein yang diperlukan demi kelangsungan neuron motor.[8] Kehilangan neuron ini dalam saraf tunjang menghalang isyarat antara otak dan otot rangka.[8] Satu lagi gen, SMN2, dianggap sebagai gen pengubah suai penyakit, kerana biasanya semakin banyak salinan SMN2, semakin ringan perjalanan penyakit. Diagnosis SMA adalah berdasarkan simptom dan disahkan oleh ujian genetik.[9][1]
Biasanya, mutasi dalam gen SMN1 diwarisi daripada kedua ibu bapa secara resesif di autosom, walaupun dalam sekitar 2% kes ia berlaku semasa perkembangan awal (de novo).[1][10] Insiden atrofi otot spina di seluruh dunia berbeza-beza, daripada kira-kira 1 dalam 4,000 kelahiran hingga sekitar 1 dalam 16,000 kelahiran,[11] dengan kadar 1 dalam 7,000 dan 1 dalam 10,000 lazimnya dikira bagi Eropah dan AS masing-masing.[2]
Hasil dalam perjalanan semula jadi penyakit ini berbeza dari kematian dalam beberapa minggu selepas kelahiran dalam kes yang paling akut kepada jangka hayat normal dalam bentuk SMA yang berlarutan.[8] Pengenalan rawatan punca pada 2016 telah meningkatkan hasil dengan ketara. Ubat-ubatan yang menyasarkan punca genetik penyakit ini termasuk nusinersen, risdiplam, dan ubat terapi gen onasemnogen abeparvovek. Penjagaan sokongan termasuk terapi fizikal, terapi pekerjaan, sokongan pernafasan, sokongan pemakanan, campur tangan ortopedik dan sokongan mobiliti.[1]
Punca
suntingAtrofi otot tulang belakang disebabkan oleh mutasi genetik dalam gen SMN1.[12]
Kromosom manusia 5 mengandungi dua gen yang hampir sama di lokasi 5q13: salinan telomer SMN1 dan salinan sentromer SMN2. Dalam individu yang sihat, gen SMN1 mengekodkan protein kemandirian neuron motor (SMN, survivor of motor neuron) memainkan peranan penting dalam kelangsungan neuron motor. Gen SMN2, sebaliknya - disebabkan oleh variasi dalam satu nukleotida (840.C→T) – menjalani hiris-cantum alternatif di persimpangan intron 6 hingga ekson 8, dengan hanya 10–20% daripada transkrip SMN2 yang mengekodkan protein kemandirian neuron motor fungsi penuh (SMN-fl) dan 80–90% transkrip menghasilkan bahan protein terpotong (SMNΔ7) yang cepat diuraikan dalam sel.[13]
Otot anggota bawah biasanya terjejas terlebih dahulu, diikuti oleh otot bahagian atas, tulang belakang dan leher dan, dalam kes yang lebih teruk, otot pernafasan dan pengunyahan. Otot proksimal biasanya terjejas lebih awal dan pada tahap yang lebih tinggi daripada otot distal.[14]
Diagnosis
suntingSMA didiagnosis menggunakan ujian genetik yang mengesan pemadaman homozigot gen SMN1 dalam lebih 95% kes,[15] dan mutasi SMN1 kompaun dalam pesakit yang tinggal. Ujian genetik biasanya dijalankan menggunakan sampel darah, dan MLPA ialah salah satu teknik ujian genetik yang lebih kerap digunakan, kerana ia juga membolehkan menentukan bilangan salinan gen SMN2, yang mempunyai kepentingan klinikal.[15]
Pengurusan
suntingUbat
suntingNusinersen (dipasarkan sebagai Spinraza) digunakan untuk merawat atrofi otot tulang belakang.[16] Ia adalah nukleotida antisense yang mengubah suai penghiriscantuman alternatif gen SMN2.[16] Ia diberikan terus kepada sistem saraf pusat menggunakan suntikan intratekal.[16][17] Nusinersen memanjangkan kelangsungan hidup dan meningkatkan fungsi motor pada bayi dengan SMA.[18][19] Ia telah diluluskan untuk digunakan di AS pada 2016, dan kegunaan di EU pada 2017.[20][21][22]
Onasemnogen abeparvovek (dipasarkan sebagai Zolgensma) ialah rawatan terapi gen yang menggunakan virus jenis 9 (scAAV-9) pelengkap pelengkap diri sebagai vektor untuk menyampaikan transgen SMN1.[23][24] Terapi ini pertama kali diluluskan di AS pada Mei 2019 sebagai formulasi intravena untuk kanak-kanak di bawah umur 24 bulan.[25][26] Kelulusan di Kesatuan Eropah, Jepun serta negara-negara lain diikuti, walaupun selalunya dengan skop kelulusan yang berbeza.[27][28]
Risdiplam (dipasarkan sebagai Evrysdi) ialah sebuah ubat cecair yang diambil melalui mulut.[29][30] Ia merupakan sebuah terbitan piridazina yang berfungsi dengan meningkatkan jumlah protein SMN-fl yang dihasilkan oleh SMN2 dengan mengolah pola hiris-cantum gen.[31][32] Risdiplam pertama kali diluluskan bagi kegunaan perubatan di Amerika pada Ogos 2020,[29] dan sejak itu, telah diluluskan di lebih 30 negara.
Prognosis
suntingTanpa rawatan farmakologi, keadaan penghidap SMA cenderung merosot dari semasa ke semasa. Baru-baru ini, kelangsungan hidup telah meningkat dalam pesakit SMA yang teruk dengan sokongan pernafasan dan pemakanan yang agresif dan proaktif.[33]
Jika tidak dirawat, majoriti kanak-kanak yang didiagnosis dengan SMA jenis 0 dan 1 tidak mencapai umur 4 tahun, dengan masalah pernafasan berulang menjadi punca utama kematian.[34] Dengan penjagaan yang betul, kes SMA jenis I yang lebih ringan (yang merangkumi lebih kurang 10% daripada semua kes SMA1) mampu hidup sehingga dewasa.[35] Kelangsungan hidup jangka panjang dalam SMA jenis I masih kekurangan bukti; walau bagaimanapun, setakat 2007, kemajuan dalam perubatan sokongan pernafasan nampaknya telah menurunkan kadar kematian.[36]
Lihat juga
suntingRujukan
sunting- ^ a b c d e f g "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Dicapai pada 27 May 2019.
- ^ a b c d e f g h i "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). Dicapai pada 27 May 2019.
- ^ "Spinal muscular atrophy". nhs.uk (dalam bahasa Inggeris). 2017-10-23. Dicapai pada 2020-10-24.
- ^ a b "Spinal muscular atrophy: MedlinePlus Genetics". medlineplus.gov (dalam bahasa Inggeris). Dicapai pada 2020-10-24.
- ^ "Spinal Muscular Atrophy (SMA) | Boston Children's Hospital". www.childrenshospital.org. Dicapai pada 2020-10-25.
- ^ "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". FDA (dalam bahasa Inggeris). 24 May 2019. Dicapai pada 27 May 2019.
- ^ "Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke". NINDS. Dicapai pada 27 May 2019.
- ^ a b c d e "Spinal muscular atrophy". Genetics Home Reference (dalam bahasa Inggeris). Dicapai pada 27 May 2019.
- ^ "Spinal Muscular Atrophy – Conditions | Children's National". childrensnational.org. Dicapai pada 2020-10-25.
- ^ Prior, Thomas W.; Leach, Meganne E.; Finanger, Erika (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (penyunting), "Spinal Muscular Atrophy", GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301526, dicapai pada 2020-10-25
- ^ Verhaart, Ingrid E. C.; Robertson, Agata; Leary, Rebecca; McMacken, Grace; König, Kirsten; Kirschner, Janbernd; Jones, Cynthia C.; Cook, Suzanne F.; Lochmüller, Hanns (July 2017). "A multi-source approach to determine SMA incidence and research ready population". Journal of Neurology (dalam bahasa Inggeris). 264 (7): 1465–1473. doi:10.1007/s00415-017-8549-1. ISSN 0340-5354. PMC 5502065. PMID 28634652.
- ^ "Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3". Nature. 344 (6266): 540–1. April 1990. Bibcode:1990Natur.344..540B. doi:10.1038/344540a0. PMID 2320125.
- ^ "Spinal muscular atrophy". Genetics Home Reference. Dicapai pada 2019-05-15.
- ^ "Consensus statement for standard of care in spinal muscular atrophy". Journal of Child Neurology. 22 (8): 1027–49. August 2007. doi:10.1177/0883073807305788. PMID 17761659.
- ^ a b Oskoui M, Darras BT, DeVivo DC (2017). "Chapter 1". Dalam Sumner CJ, Paushkin S, Ko CP (penyunting). Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. ISBN 978-0-12-803685-3.
- ^ a b c "Spinraza- nusinersen injection, solution". DailyMed. 30 June 2020. Dicapai pada 8 August 2020.
- ^ Grant, Charley (2016-12-27). "Surprise Drug Approval Is Holiday Gift for Biogen". The Wall Street Journal. ISSN 0099-9660. Dicapai pada 2016-12-27.
- ^ "Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy". New England Journal of Medicine. 377 (18): 1723–32. November 2017. doi:10.1056/NEJMoa1702752. PMID 29091570. Unknown parameter
|displayauthors=ignored (bantuan) - ^ Wadman, Renske I.; van der Pol, W. Ludo; Bosboom, Wendy Mj; Asselman, Fay-Lynn; van den Berg, Leonard H.; Iannaccone, Susan T.; Vrancken, Alexander Fje (1 June 2020). "Drug treatment for spinal muscular atrophy types II and III". The Cochrane Database of Systematic Reviews. 1 (1): CD006282. doi:10.1002/14651858.CD006282.pub5. ISSN 1469-493X. PMC 6995983. PMID 32006461.
- ^ "Spinraza (nusinersen) Injection". U.S. Food and Drug Administration (FDA). 18 January 2017. Dicapai pada 8 August 2020.
- ^ "Spinraza EPAR". European Medicines Agency (EMA). Dicapai pada 8 August 2020.
- ^ "Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy". Agence France-Presse (AFP). 2017-06-01. Dicapai pada 2017-06-01.
- ^ "Zolgensma 2 x 1013 vector genomes/mL solution for infusion". www.medicines.org.uk. Dicapai pada 8 August 2020.
- ^ "Zolgensma- onasemnogene abeparvovec-xioi kit". DailyMed. 24 May 2019. Dicapai pada 8 August 2020.
- ^ "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality" (Siaran akhbar). 24 May 2019. Dicapai pada 27 May 2019. Rencana ini mengandungi teks dari suatu penerbitan yang kini berada dalam domain awam:
- ^ "Zolgensma". U.S. Food and Drug Administration (FDA). 24 May 2019. Dicapai pada 8 August 2020.
- ^ "Zolgensma EPAR". European Medicines Agency (EMA). 24 March 2020. Dicapai pada 8 August 2020.
- ^ "Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)" (Siaran akhbar). Dicapai pada 8 August 2020.
- ^ a b "FDA Approves Oral Treatment for Spinal Muscular Atrophy". U.S. Food and Drug Administration (FDA) (Siaran akhbar). 7 August 2020. Dicapai pada 7 August 2020.
- ^ "Evrysdi (risdiplam) for oral solution" (PDF). Genentech. Dicapai pada 8 August 2020.
- ^ Maria Joao Almeida (2016-09-08). "RG7916". BioNews Services. Dicapai pada 2017-10-08.
- ^ Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, dll. (May 2016). "Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy". Human Molecular Genetics. 25 (10): 1885–1899. doi:10.1093/hmg/ddw062. PMC 5062580. PMID 26931466.
- ^ Darras B, Finkel R (2017). Spinal Muscular Atrophy. United Kingdom, United States: Elsevier. m/s. 417. ISBN 978-0-12-803685-3.
- ^ Yuan N, Wang CH, Trela A, Albanese CT (June 2007). "Laparoscopic Nissen fundoplication during gastrostomy tube placement and noninvasive ventilation may improve survival in type I and severe type II spinal muscular atrophy". Journal of Child Neurology. 22 (6): 727–31. doi:10.1177/0883073807304009. PMID 17641258. S2CID 38799022.
- ^ Bach JR (May 2007). "Medical considerations of long-term survival of Werdnig-Hoffmann disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 349–55. doi:10.1097/PHM.0b013e31804b1d66. PMID 17449979. S2CID 39989993.
- ^ Oskoui M, Levy G, Garland CJ, Gray JM, O'Hagen J, De Vivo DC, Kaufmann P (November 2007). "The changing natural history of spinal muscular atrophy type 1". Neurology. 69 (20): 1931–6. doi:10.1212/01.wnl.0000290830.40544.b9. PMID 17998484. S2CID 7528894.
