Adenosina monofosfat
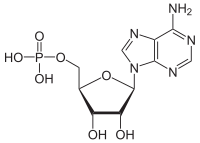
Adenosina monofosfat (AMP), juga dikenali sebagai asid 5'-adenilik, ialah nukleotida. AMP terdiri daripada kumpulan fosfat, gula ribosa, dan nukleobes adenina. Ia adalah ester asid fosforik dan adenosina.[1] Sebagai gantian, ia mengambil bentuk awalan adenilil-.[2]
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Asid 5′-adenilik
| |
| Nama IUPAC sistematik
[(2R,3S,4R,5R)-5-(6-Amino-9H-purin-9-il)-3,4-dihidroksioksolan-2-yl]metil dihidrogen fosfat | |
| Nama lain
Adenosina 5'-monofosfat
| |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.455 |
| KEGG | |
| MeSH | Adenosine+monophosphate |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C10H14N5O7P | |
| Jisim molar | 347.22 g/mol |
| Rupa bentuk | Serbuk hablur putih |
| Ketumpatan | 2.32 g/mL |
| Takat lebur | 178 hingga 185 °C (352 hingga 365 °F; 451 hingga 458 K) |
| Takat didih | 798.5 °C (1,469.3 °F; 1,071.7 K) |
| Keasidan (pKa) | 0.9[perlu rujukan], 3.8, 6.1 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
AMP memainkan peranan penting dalam banyak proses metabolik selular, dan ditukar kepada ADP dan/atau ATP, serta enzim pengaktifan alosterik seperti miofosforilase-b. AMP juga merupakan komponen dalam sintesis RNA.[3] AMP hadir dalam semua bentuk kehidupan yang diketahui.[4]
Pengeluaran dan penguraian
suntingAMP tidak mempunyai ikatan fosfoanhidrida tenaga tinggi yang dikaitkan dengan ADP dan ATP. AMP boleh dihasilkan daripada ADP oleh tindak balas miokinase (adenilat kinase) apabila takungan ATP dalam sel rendah:[5][6]
- 2 ADP → ATP + AMP
Selain itu, AMP mungkin dihasilkan oleh hidrolisis satu ikatan fosfat tenaga tinggi ADP:
- ADP + H2O → AMP + Pi
AMP juga boleh dibentuk melalui hidrolisis ATP menjadi AMP dan pirofosfat:
- ATP + H2O → AMP + PPi
Apabila RNA diuraikan oleh sistem hidup, monofosfat nukleosida, termasuk adenosina monofosfat, terbentuk.
AMP boleh dijana semula menjadi ATP seperti berikut:
- AMP + ATP → 2 ADP (adenilate kinase, arah terbalik)
- ADP + Pi → ATP (langkah ini paling kerap dilakukan dalam sistem aerob oleh sintase ATP semasa pemfosforilan oksidatif)
AMP boleh ditukar kepada IMP oleh enzim mioadenilat deaminase, membebaskan kumpulan ammonia.
Dalam laluan katabolik, kitaran nukleotida purina, adenosina monofosfat boleh ditukar kepada asid urik yang dikumuhkan daripada badan dalam mamalia.[7]
Peranan fisiologi dalam kawal atur
suntingKawal atur kinase diaktifkan AMP
suntingEnzim sel eukariotik kinase protein diaktifkan 5' adenosina monofosfat, atau AMPK, menggunakan AMP dalam proses tenaga homeostasis semasa perbelanjaan tenaga sel yang tinggi seperti senaman.[8] Oleh kerana pembelahan ATP dan tindak balas fosforilasi yang sepadan digunakan dalam pelbagai proses di seluruh badan sebagai sumber tenaga, pengeluaran ATP diperlukan untuk terus mencipta tenaga bagi sel-sel mamalia tersebut. AMPK, sebagai penderia tenaga selular, diaktifkan dengan menurunkan tahap ATP, yang secara semula jadi disertai dengan peningkatan tahap ADP dan AMP.[9]
Walaupun fosforilasi kelihatan sebagai pengaktif utama AMPK, beberapa kajian mencadangkan bahawa AMP ialah pengawal selia alosterik serta agonis langsung AMPK.[10] Tambahan pula, kajian lain mencadangkan bahawa nisbah tinggi paras AMP:ATP dalam sel, bukannya AMP sahaja, mengaktifkan AMPK.[11] Sebagai contoh, kinase Caenorhabditis elegans dan Drosophila melanogaster yang diaktifkan oleh AMP didapati telah diaktifkan oleh AMP, manakala yis dan kinase tumbuhan tidak diaktifkan secara alosterik oleh AMP.[11]
AMP mengikat kepada subunit γ AMPK lalu membawa kepada pengaktifan kinase, dan kemudian akhirnya satu rantaian proses lain seperti pengaktifan laluan katabolik dan perencatan laluan anabolik untuk menjana semula ATP. Mekanisme katabolik yang menjana ATP melalui pembebasan tenaga daripada pemecahan molekul diaktifkan oleh enzim AMPK manakala mekanisme anabolik yang menggunakan tenaga daripada ATP untuk membentuk produk pula dihalang.[12] Walaupun subunit γ boleh mengikat AMP/ADP/ATP, hanya pengikatan AMP/ADP mengakibatkan anjakan konformasi protein enzim. Kelainan dalam pengikatan AMP/ADP berbanding ATP ini membawa kepada peralihan dalam keadaan penyahfosforilan untuk enzim.[13] Defosforilasi AMPK melalui pelbagai fosfatase protein menyahaktifkan fungsi pemangkin sepenuhnya. AMP/ADP melindungi AMPK daripada dinyahaktifkan dengan mengikat subunit γ dan mengekalkan keadaan nyahfosforilasi.[14]
cAMP
suntingAMP juga boleh wujud sebagai struktur bergelang yang dikenali sebagai AMP siklik (atau cAMP). Dalam sel tertentu, enzim adenilat siklase membuat cAMP daripada ATP, dan lazimnya tindak balas ini dikawal oleh hormon seperti aadrenalina atau glukagon. cAMP memainkan peranan penting dalam isyarat intrasel.[15] Dalam otot rangka, cAMP yang dicetuskan oleh adrenalina memulakan rantaian (laluan bergantung cAMP) dalam penukaran miofosforilase-b kepada bentuk miofosforilase-a berfosfat bagi glikogenolisis.[16][17]
Rujukan
sunting- ^ "Adenosine monophosphate (Compound)". PubChem. NCBI. Dicapai pada 30 April 2020.
- ^ "Nomenclature of Carbohydrates: (Recommendations 1996)". Journal of Carbohydrate Chemistry. 16 (8): 1191–1280. 1997. doi:10.1080/07328309708005748.
- ^ "Spontaneous Formation of RNA Strands, Peptidyl RNA, and Cofactors". Angewandte Chemie. 54 (48): 14564–9. November 2015. doi:10.1002/anie.201506593. PMC 4678511. PMID 26435376.
- ^ "Adenosine monophosphate". The Human Metabolome Database. Dicapai pada 3 July 2020.
- ^ Baker, Julien S.; McCormick, Marie Clare; Robergs, Robert A. (2010). "Interaction among Skeletal Muscle Metabolic Energy Systems during Intense Exercise". Journal of Nutrition and Metabolism. 2010: 905612. doi:10.1155/2010/905612. ISSN 2090-0732. PMC 3005844. PMID 21188163.
- ^ Valberg, Stephanie J. (2008-01-01), Kaneko, J. Jerry; Harvey, John W.; Bruss, Michael L. (penyunting), "Chapter 15 - Skeletal Muscle Function", Clinical Biochemistry of Domestic Animals (Sixth Edition), San Diego: Academic Press: 459–484, ISBN 978-0-12-370491-7, dicapai pada 2023-10-10
- ^ "Regulation of uric acid metabolism and excretion". International Journal of Cardiology. 213: 8–14. June 2016. doi:10.1016/j.ijcard.2015.08.109. PMID 26316329.
- ^ "AMPK and the biochemistry of exercise: implications for human health and disease". The Biochemical Journal. 418 (2): 261–75. March 2009. doi:10.1042/BJ20082055. PMC 2779044. PMID 19196246.
- ^ "AMP-activated protein kinase: nature's energy sensor". Nature Chemical Biology (dalam bahasa Inggeris). 7 (8): 512–8. July 2011. doi:10.1038/nchembio.610. PMID 21769098.
- ^ "The AMP-activated protein kinase (AMPK) and cancer: many faces of a metabolic regulator". Cancer Letters. 356 (2 Pt A): 165–70. January 2015. doi:10.1016/j.canlet.2014.01.018. PMID 24486219.
- ^ a b "AMP-activated protein kinase—an energy sensor that regulates all aspects of cell function". Genes & Development (dalam bahasa Inggeris). 25 (18): 1895–1908. 2011-09-15. doi:10.1101/gad.17420111. ISSN 0890-9369. PMC 3185962. PMID 21937710.
- ^ "Energy sensing by the AMP-activated protein kinase and its effects on muscle metabolism". The Proceedings of the Nutrition Society. 70 (1): 92–9. February 2011. doi:10.1017/S0029665110003915. PMID 21067629.
- ^ "Adenosine monophosphate-activated kinase and its key role in catabolism: structure, regulation, biological activity, and pharmacological activation". Molecular Pharmacology. 87 (3): 363–77. March 2015. doi:10.1124/mol.114.095810. PMID 25422142.
- ^ "Structure of mammalian AMPK and its regulation by ADP". Nature. 472 (7342): 230–3. April 2011. Bibcode:2011Natur.472..230X. doi:10.1038/nature09932. PMC 3078618. PMID 21399626.
- ^ Ravnskjaer K, Madiraju A, Montminy M (2015). Metabolic Control. Handbook of Experimental Pharmacology. 233. Springer, Cham. m/s. 29–49. doi:10.1007/164_2015_32. ISBN 9783319298047. PMID 26721678.
- ^ Coffee, Carole J. (1999). Quick Look Medicine: Metabolism. Hayes Barton Press. ISBN 1-59377-192-4.
- ^ "15.3: Glycogenolyis and its Regulation by Glucagon and Epinephrine Signaling". Biology LibreTexts (dalam bahasa Inggeris). 2022-01-01. Dicapai pada 2023-10-10.
Bacaan lanjut
sunting- Ming D, Ninomiya Y, Margolskee RF (August 1999). "Blocking taste receptor activation of gustducin inhibits gustatory responses to bitter compounds". Proceedings of the National Academy of Sciences of the United States of America. 96 (17): 9903–8. Bibcode:1999PNAS...96.9903M. doi:10.1073/pnas.96.17.9903. PMC 22308. PMID 10449792.